Hibridacion Buenastareas.docx 2o5j3e
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 445h4w
Overview 1s532p
& View Hibridacion Buenastareas.docx as PDF for free.
More details 6h715l
- Words: 3,359
- Pages: 9
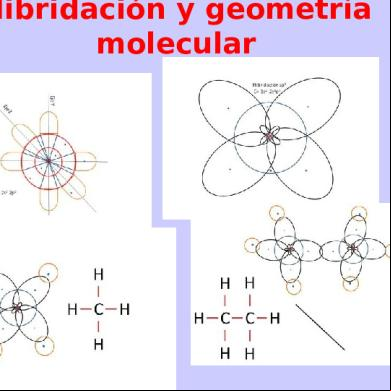
HIBRIDACION La hibridación, es la forma en la que los orbitales (s,p,d,f) se distribuyen los electrones para formar enlaces, esto tiene que ver con la configuración electrónica, la cual te da una idea mas clara, un ejemplo seria los enlaces que puede formar el carbono, la configuración electrónica del carbono es 2p2, para su ultimo electrón, con esta configuración, el carbono solo puede formar dos enlaces, así que pasa un electrón del orbital 2s al orbital 2p, para de esta forma poder enlazarse hasta con cuatro elementos mas, la hibridación depende del numero de enlaces, para un elemento que tiene dos enlaces, como seria el caso del oxigeno en la molécula de H2O seria una hibridación sp, para un elemento con tras enlaces la hibridación seria sp2, para uno de 4 seria sp3, los enlaces dobles cuentan como uno solo, además de que la hibridación te da también la forma en que se acomodan las moléculas en el espacio, ya sea lineal, trigonal y tetraédrica; la hibridación es la mezcla de orbitales atómicos para formar nuevos orbitales apropiados para crear enlaces. En química, se habla de hibridación cuando en un átomo, se mezcla el orden de los electrones entre orbitales creando una configuración electrónica nueva, un orbital híbrido que describa la forma en que en la realidad se disponen los electrones para producir las propiedades que se observan en los enlaces atómicos. GEOMETRIA MOLECULAR La geometría molecular o estructuramolecular se refiere a la disposición tri-dimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc. Actualmente, el principal modelo de geometría molecular es la Teoría de Repulsión de Pares de Electrones de Valencia (TRePEV), empleada internacionalmente por su gran predictibilidad. ENLACES ATÓMICOS Por definición, los átomos en las moléculas suelen estar unidos unos a otros con enlaces covalentes, que involucran a enlaces simples, dobles o triples, donde un "enlace" es un par de electrones compartidos (la otra forma de unión entre átomos se denomina enlace iónico e involucra a cationes (iones positivos), y aniones (iones negativos). La geometría molecular puede ser especificada en términos de longitud de enlace, ángulo de enlace y ángulo torsional. La longitud de enlace está definida como la distancia media entre los centros de dos átomos enlazados en una moléculada dada. Un ángulo de enlace es el ángulo formado por tres átomos enlazados consecutivamente. Para cuatro átomos unidos consecutivamente en una cadena línea, el ángulo torsional es el ángulo entre el plano formado por los tres primeros átomos y el plano formado por los tres últimos átomos. ALCANOS: Son estructuras de enlaces sencillos, son apolares son solubles solo en compuestos orgánicos y repelen el agua, su formula general es CnH2+2.LOS ALCANOS Y LA HIBRIDACIÓN SP3. Cuando el átomo de carbono va a formar parte de una molécula utilizando su saturación máxima, uno de los electrones del orbital atómico 2s, salta al orbital 2pz que está vacío. Este salto tiene por supuesto un costo en energía, el cual es compensado sobradamente con la energía que es liberada
al formar el enlace entre uno de estos nuevos orbitales híbridos sp3 del carbono y el orbital del otro átomo. Por ejemplo C-C o C-H. Así, todos los orbitales del nivel 2 quedan con un electrón cada uno. Y en ese momento al combinarse entre sí, dan origen a cuatro orbitales híbridos.
Los alcanos son hidrocarburos que sólo contienen enlaces sencillos. Se clasifican en alcanos lineales, ramificados, cíclicos y policíclicos. Los alcanos lineales forman una serie homologa ya que sólo difieren en el número de -CH2- y pueden obtenerse a partir de una formula general: CH3-(CH2)n-CH3 Los alcanos son compuestos formados solo por átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de grupos funcionales como el carbonilo (-CO), carboxilo (-COOH), amida (-CON=), etc. La relación C/H es de CnH2n+2 siendo n el número de átomos de carbono de la molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos). Esto hace que su reactividad sea muy reducida en comparación con otros compuestos orgánicos, y es lacausa de su nombre no sistemático: parafinas (del latín, poca afinidad). Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir, covalentes por compartición de un par de electrones en un orbital s, por lo cual la estructura de un alcano sería de la forma: Donde cada línea representa un enlace covalente. El alcano más sencillo es el metano con un solo átomo de carbono. Otros alcanos conocidos son el etano, propano y el butano con dos, tres y cuatro átomos de carbono respectivamente. A partir de cinco carbonos, los nombres se derivan de numerales griegos: pentano, hexano, heptano... Estos son algunos ejemplos de alcanos: LONGITUDES DE ENLACE Y ÁNGULOS DE ENLACE Una molécula de alcano tiene sólo enlaces simples C – H y C – C. Los primeros resultan del traslape de un orbital sp3 del átomo de carbono con el orbital 1s de un átomo de hidrógeno; los últimos del traslape de dos orbitales sp3 en átomos de carbono diferentes. La longitud de enlace es de 1,09×10−10 m para un enlace C – H y 1,54×10−10 m para un enlace C – C. La disposición espacial de los enlaces es similar a la de cuatro orbitales sp3; están dispuestos tetraédricamente, con un ángulo de 109,48° entre ellos. La fórmula estructural que representa a los enlaces como si estuvieran en ángulos rectos unos con otros, aunque común y útil, no corresponde con la realidad. ALQUENOS El doble enlace carbono-carbono de los alquenos es más corto queel enlace simple correspondiente de los alcanos, porque cuatro electrones unen más estrechamente que dos. Pero, además, ciertos enlaces adicionales son apreciablemente más cortos en los alquenos que los correspondientes en los alcanos; por ejemplo, la distancia C-H en el etileno es de 1.103 Å,
comparada con 1.112 Å, en el etano. Para justificar ésta y otras diferencias en longitudes de enlaces, debemos considerar diferencias en la hibridación del carbono. Los enlaces carbono-hidrógeno del etileno son simples, como también lo son los del etano, pero aquéllos se originan por solapamiento de orbitales sp2 del carbono, en vez de sp3, como en el etano. Comparado con un orbital sp3, uno sp2 tiene menos carácter p y más carácter s. Un orbital p se extiende hasta cierta distancia del núcleo, mientras que el s está muy cerca de el: a medida que aumenta el carácter s de un orbital híbrido, disminuye su tamaño efectivo, con lo que también se acorta la longitud del enlace con otro átomo dado, de dado que un enlace carbono-hidrógeno sp2-s debería ser más corto que uno sp3-s. El benceno, cuya molécula es en muchos sentidos muy distinta que la del etileno también tiene enlaces carbono-hidrógeno sp2-s de longitud 1.10 Å, casi igual que la del etileno. El acetileno contiene carbono con hibridación sp que, en vista del carácter s aún mayor de sus orbitales debería formar enlaces todavía más cortos que los del etileno, lo que es correcto, ya que elenlace sp-s mide solamente 1.079 Å. Al considerar el tamaño orbital en función de la hibridación, se llega a la conclusión de que un enlace sp2-sp3 debería ser más corto que un enlace sp3-sp3, lo que es corroborado por el hecho de que el enlace simple carbono-carbono del propileno mide 1.501 Å, en comparación con 1.534 Å que mide el enlace correspondiente del etano. El enlace simple carbono sp-sp3 del metilacetileno es aún más corto, 1.459 Å. Estas diferencias en las longitudes de los enlaces simples carbonocarbono son mayores que las correspondientes a los enlaces carbono-hidrógeno; sin embargo, podría operar otro factor aparte de la hibridación particular del carbono. Una estimación del tamaño orbital en función de la hibridación nos ayuda a comprender otras propiedades de las moléculas, además de las longitudes de enlace; por ejemplo, las acideces relativas de ciertos y las basicidades relativas de ciertas aminas .Es razonable suponer que los enlaces más cortos son más firmes .la energía de disociación del enlace C-H para el etileno (108 jcal) es mayor que para el etano (98 kcal), y la del enlace (simple) C-C es mayor para el propileno (92 kcal) que para el etano (88 kcal). los cambios en la hibridación pueden ser de importancia más fundamental que la reconocida generalmente, porque afectan a la estabilidad de las moléculas. EJEMPLOS DE ALQUENOS: El miembro más sencillo de la familia de los alquenos es el etileno, C2H4. En vista dela fácil conversión del etileno en etano, es razonable suponer que ambos tienen cierta similitud estructural. En consecuencia, comenzamos conectando los átomos de carbono con un enlace covalente y luego unimos a cada uno de ellos dos átomos de hidrógeno. En esta etapa, cada carbono tiene solamente seis electrones de valencia, en vez de los ocho requeridos, y a la molécula entera aún le falta un par para ser neutra. Podemos resolver ambos problemas si damos por sentado que los carbonos pueden compartir dos pares de electrones y, para describir esta situación, decimos que están unidos por un doble enlace. El doble enlace carbono-carbono es el rasgo característico de la estructura de los alquenos. El siguiente miembro de la familia de los alquenos es el propileno, C3H6. Dada su gran similitud con el etileno, parece razonable suponer que este compuesto también tiene un doble enlace
carbono-carbono. Partiendo de los dos átomos de carbono conectados con un enlace doble y enlazando los demás átomos de acuerdo con la regla de una unión por hidrógeno y cuatro por carbono, llegamos a la estructura
Como clase, los alquenos poseen propiedades físicas esencialmente iguales que las de los alcanos. Son insolubles en agua, pero bastante solubles en líquidos no polares, como benceno, éter, cloroformo o ligroína, y son menos densos que el agua, el punto de ebullición aumenta con el número creciente de carbonos; como en el caso de losalcanos, el aumento del punto de ebullición es de 20 a 30 grados por cada carbono adicional, excepto para los homólogos muy pequeños. Las ramificaciones bajan el punto de ebullición. el punto de ebullición de un alqueno es muy parecido al del alcano con un esqueleto carbonado correspondiente. Al igual que los alcanos, los alquenos son, a lo sumo, sólo débilmente polares. Puesto que los electrones n muy sueltos del doble enlace se desplazan con facilidad, sus momentos dipolares son mayores que los de los alcanos; sin embargo, son pequeños. ALQUINOS Los alquinos son hidrocarburos que se características por poseer un grupo funcional del tipo triple enlace carbono – carbono. La formula general de los alquinos es CnH2n-2. Los átomos de carbono de los alquinos tienen hibridación sp, y el triple enlace esta formado por un enlace sigma ϭ sp-sp y 2 π p-p. Hibridación sp. Los alquinos tienen puntos de ebullición muy similares a los de los correspondientes alcanos y alquenos. El etino es singular por el hecho de no tener punto de ebullición a presión atmosférica: sublima a -84°C. El propino y el 1-butino son gases, mientras que el 2-butino es prácticamente líq uidos destilables; por analogía con los alquenos, el reactivo carácter s de los orbitales híbridos del carbono de los alquinos sustituidos se traduce en la presencia de momentos dipolares, excepto en el caso en que los sustituyentes se encuentren distribuidos de forma totalmente simétrica.
Hibridaciones del carbono La hibridación consiste en una mezcla de orbitales puros en un estado excitado para formar orbitales hibridos equivalentes con orientaciones determinadas en el espacio. Hibridación sp3 o tetraédrica Para los compuestos en los cuales el carbono presenta enlaces simples, hidrocarburos saturados o alcanos, se ha podido comprobar que los cuatro enlaces son iguales y que están dispuestos de forma que el núcleo del átomo de carbono ocupa el centro de un tetraedro regular y los enlaces forman ángulos iguales de 109º 28' dirigidos hacia los vértices de un tetraedro. Esta configuración
se explica si se considera que los tres orbitales 2p y el orbital 2s se hibridan para formar cuatro orbitales híbridos sp3. Hibridación Metano CH4 metano CH4 Etano CH3CH3 etano CH3-CH3
Hibridación sp2 En la hibridación trigonal se hibridan los orbitales 2s, 2px y 2 py, resultando tres orbitales idénticos sp2 y un electrón en un orbital puro 2pz . Un átomo de carbono hibridizado sp2 Un átomo de carbono hibridizado sp2
El carbono hibridado sp2 da lugar a la serie de los alquenos. La molécula de eteno o etileno presenta un doble enlace: un enlace detipo σ por solapamiento de los orbitales hibridos sp2 un enlace de tipo π por solapamiento del orbital 2 pz El enlace π es más débil que el enlace σ lo cual explica la mayor reactividad de los alquenos, debido al grado de insaturación que presentan los dobles enlaces. El doble enlace impide la libre rotación de la molécula. orbitales moleculares del etileno Modelo de enlaces de orbitales moleculares del etileno formado a partir de dos átomos de carbono hibridizados sp2 y cuatro átomos de hidrógeno. Hibridación sp Los átomos que se hibridan ponen en juego un orbital s y uno p, para dar dos orbitales híbridos sp, colineales formando un ángulo de 180º. Los otros dos orbitales p no experimentan ningún tipo de
perturbación en su configuración. Hibridación sp Un átomo de carbono hibridizado sp El ejemplo más sencillo de hibridación sp lo presenta el etino. La molécula de acetileno presenta un triple enlace: a. un enlace de tipo σ por solapamiento de los orbitales hibridos sp b. dos enlaces de tipo π por solapamiento de los orbitales 2 p. etino Formación de orbitales de enlaces moleculares del etino a partir de dos átomos de carbono hibridizados sp y dosátomos de hidrógeno. Angulo de enlace Es el formado por las líneas internucleares H - C - H o H - C - C. El ángulo de enlace determina la geometría que tiene la molécula, y ésta a su vez determina el grado de estabilidad y las propiedades químicas y físicas de una sustancia. Hibridación sp3 Si los átomos que enlazan con el carbono central son iguales, los ángulos que se forman son aproximadamente de 109º 28' , valor que corresponde a los ángulos de un tetraedro regular. Cuando los átomos son diferentes, por ejemplo CHCl3, los cuatro enlaces no son equivalentes. Se formarán orbitales híbridos no equivalentes que darán lugar a un tetraedro irregular. Esta irregularidad proviene de los diferentes ángulos de enlace del carbono central, ya que la proximidad de un átomo voluminoso produce una repulsión que modifica el ángulo de enlace de los átomos más pequeños. Así, el ángulo de enlace del Br - C - Br es mayor que el tetraédrico por la repulsión que originan los dos átomos voluminosos de bromo. Hibridación sp2 La molécula tiene geometría trigonal plana en la que los ángulos de enlace H - C - C son de 120º. Hibridación sp La molécula tiene geometría lineal y el ángulo H - C - C es de 180º.
CONCEPTO DE HIBRIDACIÓN SP1, SP2, SP3: Sp1: Se define como la combinación de un orbital S y un P, para formar 2 orbitales híbridos, con orientación lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):
Se caracteriza por la presencia de 2 orbitales pi (π). Sp2: Estos mismos átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace sigma y un enlace pi (π). Las reglas de ubicación de los electrones en estos casos, como el alquenos etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes Tridimensionalmente, la distancia entre un hidrógeno y otro en algún carbono del etileno son equivalentes e iguales a un ángulo de 120°. Sp3: El átomo de carbono tiene seis electrones: dos se ubican en elorbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón): Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es extraído y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno: El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidadde llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados sp3 (un poco de ambos orbitales): De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y
tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°. FORMULAS DESARROLLADAS DE ALCANOS, ALQUENOS Y ALQUINOS. ALCANOS: Metano: CH4. Etano: CH3-CH3. Propano: CH3-CH2-CH3. Butano: CH3-CH2-CH2-CH3. ALQUENOS: Etileno: CH2=CH2 Propeno o propileno: CH2=CH-CH3 Buteno: CH2=CH-CH2-CH3 ALQUINOS: Etino: CH CH. TAMAÑO RELATIVO DE LOS ATOMOS DE CARBONO E HIDROGENO. Carbono: Radio atómico (calc) 67 pm (Radio de Bohr). Radio covalente 77 pm. Radio de Van Der Waals 170 pm. Hidrogeno: Radio medio 25 pm. Radio atómico (calc) 53 pm (Radio de Bohr). Radio covalente 37 pm. Radio de van der Waals 120 pm. ENLACES SIGMA Y PI. Enlace sigma: En química, el enlace sigma (enlace σ) es el tipo más fuerte de enlace químico covalente. El enlace sigma se define más claramente para moléculasdiatómicas usando el lenguaje y las herramientas de la simetría de grupos. En esta aproximación formal, un enlace σ es simétrico con respecto a la rotación alrededor del eje del enlace. Por esta definición, las formas comunes de enlace σ son s+s, pz+pz, s+pz, y dz2+dz2 (donde z está definido como el eje del enlace). La teoría cuántica también indica que los orbitales moleculares de simetría idéntica realmente se mezclan. Una consecuencia práctica de esta mezcla de moléculas diatómicas (equivalente a la hibridación de la Teoría del enlace de valencia), es que las funciones de onda de los orbitales moleculares s+s y pz+pz están mezclados. El alcance de esta mezcla de orbitales depende de las energías relativas de los orbitales moleculares de similar simetría. Enlace pi: En química, los enlaces pi (enlaces π) son enlaces químicos covalentes donde dos lóbulos de un
orbital electrónico se trasladan pero lo obstruyen con dos lóbulos del otro orbital electrónico involucrado. Sólo uno de los planos nodales de los orbitales pasa a través de los núcleos involucrados. ANGULOS ENTRE LOS ORBITALES DE LOS CARBONOS HIBRIDOS SP1, SP2, SP3. sp1 tiene geometría lineal, ángulo de 180°. sp2 geometría trigonal, ángulos de 120°. sp3 geometría tetraédrica, ángulos de 109.5°.
al formar el enlace entre uno de estos nuevos orbitales híbridos sp3 del carbono y el orbital del otro átomo. Por ejemplo C-C o C-H. Así, todos los orbitales del nivel 2 quedan con un electrón cada uno. Y en ese momento al combinarse entre sí, dan origen a cuatro orbitales híbridos.
Los alcanos son hidrocarburos que sólo contienen enlaces sencillos. Se clasifican en alcanos lineales, ramificados, cíclicos y policíclicos. Los alcanos lineales forman una serie homologa ya que sólo difieren en el número de -CH2- y pueden obtenerse a partir de una formula general: CH3-(CH2)n-CH3 Los alcanos son compuestos formados solo por átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de grupos funcionales como el carbonilo (-CO), carboxilo (-COOH), amida (-CON=), etc. La relación C/H es de CnH2n+2 siendo n el número de átomos de carbono de la molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos). Esto hace que su reactividad sea muy reducida en comparación con otros compuestos orgánicos, y es lacausa de su nombre no sistemático: parafinas (del latín, poca afinidad). Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir, covalentes por compartición de un par de electrones en un orbital s, por lo cual la estructura de un alcano sería de la forma: Donde cada línea representa un enlace covalente. El alcano más sencillo es el metano con un solo átomo de carbono. Otros alcanos conocidos son el etano, propano y el butano con dos, tres y cuatro átomos de carbono respectivamente. A partir de cinco carbonos, los nombres se derivan de numerales griegos: pentano, hexano, heptano... Estos son algunos ejemplos de alcanos: LONGITUDES DE ENLACE Y ÁNGULOS DE ENLACE Una molécula de alcano tiene sólo enlaces simples C – H y C – C. Los primeros resultan del traslape de un orbital sp3 del átomo de carbono con el orbital 1s de un átomo de hidrógeno; los últimos del traslape de dos orbitales sp3 en átomos de carbono diferentes. La longitud de enlace es de 1,09×10−10 m para un enlace C – H y 1,54×10−10 m para un enlace C – C. La disposición espacial de los enlaces es similar a la de cuatro orbitales sp3; están dispuestos tetraédricamente, con un ángulo de 109,48° entre ellos. La fórmula estructural que representa a los enlaces como si estuvieran en ángulos rectos unos con otros, aunque común y útil, no corresponde con la realidad. ALQUENOS El doble enlace carbono-carbono de los alquenos es más corto queel enlace simple correspondiente de los alcanos, porque cuatro electrones unen más estrechamente que dos. Pero, además, ciertos enlaces adicionales son apreciablemente más cortos en los alquenos que los correspondientes en los alcanos; por ejemplo, la distancia C-H en el etileno es de 1.103 Å,
comparada con 1.112 Å, en el etano. Para justificar ésta y otras diferencias en longitudes de enlaces, debemos considerar diferencias en la hibridación del carbono. Los enlaces carbono-hidrógeno del etileno son simples, como también lo son los del etano, pero aquéllos se originan por solapamiento de orbitales sp2 del carbono, en vez de sp3, como en el etano. Comparado con un orbital sp3, uno sp2 tiene menos carácter p y más carácter s. Un orbital p se extiende hasta cierta distancia del núcleo, mientras que el s está muy cerca de el: a medida que aumenta el carácter s de un orbital híbrido, disminuye su tamaño efectivo, con lo que también se acorta la longitud del enlace con otro átomo dado, de dado que un enlace carbono-hidrógeno sp2-s debería ser más corto que uno sp3-s. El benceno, cuya molécula es en muchos sentidos muy distinta que la del etileno también tiene enlaces carbono-hidrógeno sp2-s de longitud 1.10 Å, casi igual que la del etileno. El acetileno contiene carbono con hibridación sp que, en vista del carácter s aún mayor de sus orbitales debería formar enlaces todavía más cortos que los del etileno, lo que es correcto, ya que elenlace sp-s mide solamente 1.079 Å. Al considerar el tamaño orbital en función de la hibridación, se llega a la conclusión de que un enlace sp2-sp3 debería ser más corto que un enlace sp3-sp3, lo que es corroborado por el hecho de que el enlace simple carbono-carbono del propileno mide 1.501 Å, en comparación con 1.534 Å que mide el enlace correspondiente del etano. El enlace simple carbono sp-sp3 del metilacetileno es aún más corto, 1.459 Å. Estas diferencias en las longitudes de los enlaces simples carbonocarbono son mayores que las correspondientes a los enlaces carbono-hidrógeno; sin embargo, podría operar otro factor aparte de la hibridación particular del carbono. Una estimación del tamaño orbital en función de la hibridación nos ayuda a comprender otras propiedades de las moléculas, además de las longitudes de enlace; por ejemplo, las acideces relativas de ciertos y las basicidades relativas de ciertas aminas .Es razonable suponer que los enlaces más cortos son más firmes .la energía de disociación del enlace C-H para el etileno (108 jcal) es mayor que para el etano (98 kcal), y la del enlace (simple) C-C es mayor para el propileno (92 kcal) que para el etano (88 kcal). los cambios en la hibridación pueden ser de importancia más fundamental que la reconocida generalmente, porque afectan a la estabilidad de las moléculas. EJEMPLOS DE ALQUENOS: El miembro más sencillo de la familia de los alquenos es el etileno, C2H4. En vista dela fácil conversión del etileno en etano, es razonable suponer que ambos tienen cierta similitud estructural. En consecuencia, comenzamos conectando los átomos de carbono con un enlace covalente y luego unimos a cada uno de ellos dos átomos de hidrógeno. En esta etapa, cada carbono tiene solamente seis electrones de valencia, en vez de los ocho requeridos, y a la molécula entera aún le falta un par para ser neutra. Podemos resolver ambos problemas si damos por sentado que los carbonos pueden compartir dos pares de electrones y, para describir esta situación, decimos que están unidos por un doble enlace. El doble enlace carbono-carbono es el rasgo característico de la estructura de los alquenos. El siguiente miembro de la familia de los alquenos es el propileno, C3H6. Dada su gran similitud con el etileno, parece razonable suponer que este compuesto también tiene un doble enlace
carbono-carbono. Partiendo de los dos átomos de carbono conectados con un enlace doble y enlazando los demás átomos de acuerdo con la regla de una unión por hidrógeno y cuatro por carbono, llegamos a la estructura
Como clase, los alquenos poseen propiedades físicas esencialmente iguales que las de los alcanos. Son insolubles en agua, pero bastante solubles en líquidos no polares, como benceno, éter, cloroformo o ligroína, y son menos densos que el agua, el punto de ebullición aumenta con el número creciente de carbonos; como en el caso de losalcanos, el aumento del punto de ebullición es de 20 a 30 grados por cada carbono adicional, excepto para los homólogos muy pequeños. Las ramificaciones bajan el punto de ebullición. el punto de ebullición de un alqueno es muy parecido al del alcano con un esqueleto carbonado correspondiente. Al igual que los alcanos, los alquenos son, a lo sumo, sólo débilmente polares. Puesto que los electrones n muy sueltos del doble enlace se desplazan con facilidad, sus momentos dipolares son mayores que los de los alcanos; sin embargo, son pequeños. ALQUINOS Los alquinos son hidrocarburos que se características por poseer un grupo funcional del tipo triple enlace carbono – carbono. La formula general de los alquinos es CnH2n-2. Los átomos de carbono de los alquinos tienen hibridación sp, y el triple enlace esta formado por un enlace sigma ϭ sp-sp y 2 π p-p. Hibridación sp. Los alquinos tienen puntos de ebullición muy similares a los de los correspondientes alcanos y alquenos. El etino es singular por el hecho de no tener punto de ebullición a presión atmosférica: sublima a -84°C. El propino y el 1-butino son gases, mientras que el 2-butino es prácticamente líq uidos destilables; por analogía con los alquenos, el reactivo carácter s de los orbitales híbridos del carbono de los alquinos sustituidos se traduce en la presencia de momentos dipolares, excepto en el caso en que los sustituyentes se encuentren distribuidos de forma totalmente simétrica.
Hibridaciones del carbono La hibridación consiste en una mezcla de orbitales puros en un estado excitado para formar orbitales hibridos equivalentes con orientaciones determinadas en el espacio. Hibridación sp3 o tetraédrica Para los compuestos en los cuales el carbono presenta enlaces simples, hidrocarburos saturados o alcanos, se ha podido comprobar que los cuatro enlaces son iguales y que están dispuestos de forma que el núcleo del átomo de carbono ocupa el centro de un tetraedro regular y los enlaces forman ángulos iguales de 109º 28' dirigidos hacia los vértices de un tetraedro. Esta configuración
se explica si se considera que los tres orbitales 2p y el orbital 2s se hibridan para formar cuatro orbitales híbridos sp3. Hibridación Metano CH4 metano CH4 Etano CH3CH3 etano CH3-CH3
Hibridación sp2 En la hibridación trigonal se hibridan los orbitales 2s, 2px y 2 py, resultando tres orbitales idénticos sp2 y un electrón en un orbital puro 2pz . Un átomo de carbono hibridizado sp2 Un átomo de carbono hibridizado sp2
El carbono hibridado sp2 da lugar a la serie de los alquenos. La molécula de eteno o etileno presenta un doble enlace: un enlace detipo σ por solapamiento de los orbitales hibridos sp2 un enlace de tipo π por solapamiento del orbital 2 pz El enlace π es más débil que el enlace σ lo cual explica la mayor reactividad de los alquenos, debido al grado de insaturación que presentan los dobles enlaces. El doble enlace impide la libre rotación de la molécula. orbitales moleculares del etileno Modelo de enlaces de orbitales moleculares del etileno formado a partir de dos átomos de carbono hibridizados sp2 y cuatro átomos de hidrógeno. Hibridación sp Los átomos que se hibridan ponen en juego un orbital s y uno p, para dar dos orbitales híbridos sp, colineales formando un ángulo de 180º. Los otros dos orbitales p no experimentan ningún tipo de
perturbación en su configuración. Hibridación sp Un átomo de carbono hibridizado sp El ejemplo más sencillo de hibridación sp lo presenta el etino. La molécula de acetileno presenta un triple enlace: a. un enlace de tipo σ por solapamiento de los orbitales hibridos sp b. dos enlaces de tipo π por solapamiento de los orbitales 2 p. etino Formación de orbitales de enlaces moleculares del etino a partir de dos átomos de carbono hibridizados sp y dosátomos de hidrógeno. Angulo de enlace Es el formado por las líneas internucleares H - C - H o H - C - C. El ángulo de enlace determina la geometría que tiene la molécula, y ésta a su vez determina el grado de estabilidad y las propiedades químicas y físicas de una sustancia. Hibridación sp3 Si los átomos que enlazan con el carbono central son iguales, los ángulos que se forman son aproximadamente de 109º 28' , valor que corresponde a los ángulos de un tetraedro regular. Cuando los átomos son diferentes, por ejemplo CHCl3, los cuatro enlaces no son equivalentes. Se formarán orbitales híbridos no equivalentes que darán lugar a un tetraedro irregular. Esta irregularidad proviene de los diferentes ángulos de enlace del carbono central, ya que la proximidad de un átomo voluminoso produce una repulsión que modifica el ángulo de enlace de los átomos más pequeños. Así, el ángulo de enlace del Br - C - Br es mayor que el tetraédrico por la repulsión que originan los dos átomos voluminosos de bromo. Hibridación sp2 La molécula tiene geometría trigonal plana en la que los ángulos de enlace H - C - C son de 120º. Hibridación sp La molécula tiene geometría lineal y el ángulo H - C - C es de 180º.
CONCEPTO DE HIBRIDACIÓN SP1, SP2, SP3: Sp1: Se define como la combinación de un orbital S y un P, para formar 2 orbitales híbridos, con orientación lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):
Se caracteriza por la presencia de 2 orbitales pi (π). Sp2: Estos mismos átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace sigma y un enlace pi (π). Las reglas de ubicación de los electrones en estos casos, como el alquenos etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes Tridimensionalmente, la distancia entre un hidrógeno y otro en algún carbono del etileno son equivalentes e iguales a un ángulo de 120°. Sp3: El átomo de carbono tiene seis electrones: dos se ubican en elorbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón): Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es extraído y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno: El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidadde llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados sp3 (un poco de ambos orbitales): De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y
tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°. FORMULAS DESARROLLADAS DE ALCANOS, ALQUENOS Y ALQUINOS. ALCANOS: Metano: CH4. Etano: CH3-CH3. Propano: CH3-CH2-CH3. Butano: CH3-CH2-CH2-CH3. ALQUENOS: Etileno: CH2=CH2 Propeno o propileno: CH2=CH-CH3 Buteno: CH2=CH-CH2-CH3 ALQUINOS: Etino: CH CH. TAMAÑO RELATIVO DE LOS ATOMOS DE CARBONO E HIDROGENO. Carbono: Radio atómico (calc) 67 pm (Radio de Bohr). Radio covalente 77 pm. Radio de Van Der Waals 170 pm. Hidrogeno: Radio medio 25 pm. Radio atómico (calc) 53 pm (Radio de Bohr). Radio covalente 37 pm. Radio de van der Waals 120 pm. ENLACES SIGMA Y PI. Enlace sigma: En química, el enlace sigma (enlace σ) es el tipo más fuerte de enlace químico covalente. El enlace sigma se define más claramente para moléculasdiatómicas usando el lenguaje y las herramientas de la simetría de grupos. En esta aproximación formal, un enlace σ es simétrico con respecto a la rotación alrededor del eje del enlace. Por esta definición, las formas comunes de enlace σ son s+s, pz+pz, s+pz, y dz2+dz2 (donde z está definido como el eje del enlace). La teoría cuántica también indica que los orbitales moleculares de simetría idéntica realmente se mezclan. Una consecuencia práctica de esta mezcla de moléculas diatómicas (equivalente a la hibridación de la Teoría del enlace de valencia), es que las funciones de onda de los orbitales moleculares s+s y pz+pz están mezclados. El alcance de esta mezcla de orbitales depende de las energías relativas de los orbitales moleculares de similar simetría. Enlace pi: En química, los enlaces pi (enlaces π) son enlaces químicos covalentes donde dos lóbulos de un
orbital electrónico se trasladan pero lo obstruyen con dos lóbulos del otro orbital electrónico involucrado. Sólo uno de los planos nodales de los orbitales pasa a través de los núcleos involucrados. ANGULOS ENTRE LOS ORBITALES DE LOS CARBONOS HIBRIDOS SP1, SP2, SP3. sp1 tiene geometría lineal, ángulo de 180°. sp2 geometría trigonal, ángulos de 120°. sp3 geometría tetraédrica, ángulos de 109.5°.